Alkoholy
Charakteristika
- Kyslíkaté deriváty uhlovodíků, které obsahují 1 nebo více funkčních skupin OH
- Skupina OH je vázána na uhlík, který není součástí aromatického jádra
Rozdělení
- Podle počtu skupin OH:
a, jednosytný – 1 skupina OH
b, dvojsytný – 2 skupiny OH
c, trojsytný – 3 skupiny OH
d, vícesytný – více skupin OH - Podle počtu atomů vodíku, které jsou na uhlíku, na kterém je navázaná skupina OH:a, primární alkohol –CH2 – OH
b, sekundární alkohol –CH – OH
׀ ׀
c, terciální alkohol –C–OH
׀
Rozbor struktury
- Vazby jsou polární, i molekula navenek má polární charakter
H3C – H2Cδ+ ◄ Oδ- ►Hδ+
záporný indukční efekt I–
Názvosloví
- Název tvoříme názvem uhlovodíku a příponou –ol
- Polohu určujeme číslem (např. propan-2-ol) CH3 – CH(OH) – CH3
Příprava
- Kvašením cukerných roztoků – fermentací a následnou destilacíC6H12O6 -> 2 CH3CH2OH + 2 CO2
- Hydratací alkenůCH2 ═ CH2 + H2O -> CH3 – CH2OH
Vlastnosti
- Mezi molekulami alkoholu vznikají vodíkové vazby podobně jako u vody = vazby mezi kyslíkem a vodíkem
- Alkohol s vodou tvoří vazby -> snadno se rozpouští
- Nejnižší alkoholy jsou kapaliny příjemné vůně, neomezeně mísitelné s vodou
- Vyšší alkoholy jsou krystalické látky, ve vodě téměř nerozpustné
- Mají poměrně vysokou teplotu varu
- Skupina OH uděluje alkoholům amfoterní charakter -> reaguje jak s kyselinami, tak se zásadami
Základní reakce
- Vůči silným zásadám se chovají jako kyseliny za vzniku alkoholátů
- Vůči silným kyselinám se chovají jako zásady za vzniku alkoxoniových solí
- Substituční reakceCH3 – CH2 – OH + HCl -> CH3 – CH2 – Cl + H2O
ethanol chlorethan - Eliminační reakce (dehydratace)CH3 – CH2 – OH -> CH2 ═ CH2 + H2O
ethanol ethen - Oxidacea, primárních alkoholů za vzniku aldehydů až karboxylových kyselin:
ox
CH3 – CH2 – OH -> CH3 – C(HO)
ethanol acetaldehyd
ox
CH3 – C(HO) -> CH3COOH
kyselina octováb, oxidace sekundárních alkoholů za vzniku ketonů:
ox
H3C – CH – CH3 -> CH3 – C – CH3
׀ ׀׀
OH O
propan-2-ol dimethylketon, aceton - Esterifikace = reakce alkoholů s kyselinami za vzniku esteru a vodyCH3COOH + CH3CH2OH -> CH3 – CO – O – CH2 – CH3 + H2O
ethylester kyseliny octové,
ethylacetát
Zástupci
Methanol CH3OH
- Bezbarvá kapalina, příjemné vůně, neomezeně mísitelná s vodou
- Těžce vzhledem odlišitelný od ethylenu
- Prudce jedovatý, jeho požitím hrozí oslepnutí až smrt
- Výborné rozpouštědlo
- Používá se na výrobu formaldehydu k výrobě formaldehydových pryskyřic (umakart)
Ethanol CH3CH2OH
- Triviální název: líh
- Bezbarvá kapalina, příjemné vůně, neomezeně mísitelná s vodou
- Získává se ethanolovým kvašením cukerných šťáv
- Snadno ho lze připravit v domácích podmínkách
- Obsažen v alkoholických nápojích, dlouhodobé požívání může vyvolat závislost
- Ve větším množství dochází k poškození jater, ledvin, nervového systému
- Sráží bílkoviny
- Používá se k výrobě kosmetiky, léčiv, jako dezinfekční prostředek, rozpouštědlo a k chemických syntézám
- Pro technické účely se denaturuje
Denaturace
· Znehodnocování alkoholu, aby se stal nepoživatelným
- Pro denaturaci se používají láky blízké teplotě varu alkoholu a nepříjemného zápachu
- Např. benzin, pyridin
Ethylenglykol CH2OH – CH2OH
- Jedovatá olejovitá kapalina, neomezeně mísitelná s vodou
- Má nasládlou chuť
- Používá se jako složka do nemrznoucích směsí (Fridex)
- Dobré rozpouštědlo, výroba plastů
Glycerol CH2OH – CHOH – CH2OH
- Glicerin, propan-1,2,3-triol
- Vysokovroucí sirupovitá kapalina sladké chuti, neomezeně mísitelná s vodou
- Používá se v kosmetice (krémy na ruce)
- Výroba plastických hmot
- Výroba glicerolnitrátu = nitroglicerin
Výbušný při nárazu
Objevitel je Alfred Nobel
V malých dávkách se používá při angíně pectoris
Fenoly
Charakteristika
- Kyslíkaté deriváty uhlovodíků, ve kterých je skupina OH přímo vázána na aromatické jádro
- Acidita hydroxyderivátů klesá v pořadí: kyselina pikrová – fenol – voda – methanol
Rozdělení podle počtu OH skupin
- Jednosytné: fenol, kresoly, kyselina pikrová
- Vícesytné: pyrokatechol, resorcinol, hydrochinon, fluoroglucinol, pyrogallol, hydroxihydrochinon.
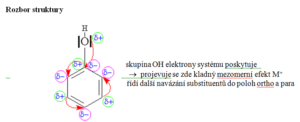
Příprava
- Připravují se izolací z černouhelného dehtu
- U nás v závodech DEZA Valašské Meziříčí
Vlastnosti
- Fenoly jsou pevné látky nepříjemného zápachu
- Leptají pokožku sliznice
- Málo rozpustné ve vodě
- Některé se používají jako dezinfekční prostředky
Základní reakce
Reakce na hydroxylové skupině
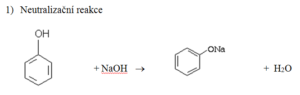
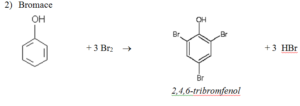
Zástupci
Fenol
- Bezbarvá krystalická látka, která na vzduchu červená
- Leptá pokožku
- Požívá se při výrobě plastů, léčiv, pesticidů, barviv
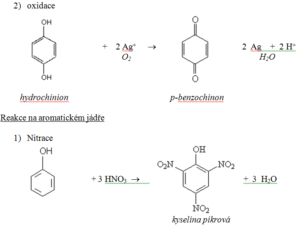
Kyselina pikrová
- Vzniká nitrací fenolu
- Tvoří žluté krystalky silně hořké chuti (pikros = hořký)
- Používá se jako trhavina
Dvojsytné fenoly
- Pyrokatechol, hydrochinon – složkou fotografických vývojek
- Rezorcinol – v kožním lékařství jako antiseptikum
Ethery
Charakteristika
- Kyslíkaté deriváty uhlovodíků, ve kterých jsou vázané 2 uhlovodíkové zbytky
- Deriváty vody R1 – O – R2
- Rozdělení:
a, symetrické – stejné uhlovodíkové zbytky
b, nesymetrické – různé uhlovodíkové zbytky
Rozbor struktury
H3Cδ+ ◄ Oδ- ►CH3δ+
E+ N–
- Molekula jako celek není polární ->nepolární rozpouštědlo
Názvosloví
- V abecední pořádku seřadíme názvy uhlovodíkových zbytků + přípona etherfenyl(methyl)ether ethyl(vynil)ether ethyl(fenyl)ether
- Lze-li jeden z uhlovodíkových zbytků hodnotit jako nadřazený, vyjádříme ho jménem.
Druhý uhlovodíkový zbytek vyjádříme předponou a přidáme oxy.etoxybenzen metoxybenzen metoxyethan
Příprava
- Ethery se stejnými uhlovodíkovými zbytky připravujeme z alkoholů působením H2SO4
2 CH3 – CH2 – OH -> CH3 – CH2 – O – CH2 – CH3
diethylether - Ethery s různými uhlovodíkovými zbytky se připravují z alkylhalogenidů reakcí s alkoholátyCH3Cl + CH3CH2ONa -> NaCl + CH3 – O – CH2 – CH3
ethanolát sodný ethylmethylether
Vlastnosti
- Většinou kapaliny
- Charakteristické svou vůní
- Teplota varu je nižší než u alkanů
- Jsou těkavé, hořlavé
- Nevytvářejí vodíkové můstky
- Velmi dobrá nepolární rozpouštědla
Zástupci
Diethylether
- Těkavá, vysoce hořlavá kapalina
- Používá se jako rozpouštědlo
- Dříve používaný jako anestetikum – má narkotické účinky
Úkol 1:
Napište vzorce sloučenin: CH3
׀
CH2 – CH2 – CH3 CH2 – C – CH3
׀ ׀ ׀
OH OH CH3
propan-1-ol 2,2-dimethylpropan-1-ol
CH2 – CH2 – CH2 – CH2
׀ ׀
OH OH
butan-1,4-diol
CH2 – C ═ CH – CH3 CH2 – CH – CH2
׀ ׀ ׀ ׀ ׀
OH C2H5 OH OH OH
2-ethylbut-2-en-1-ol propan-1,2,3-triol, glycerol
Úkol 2:
Jak byste převedli propan-2-ol na 2-jodpropan? Napište rovnici reakce.
H3C – CH(OH) – CH3 + HI ->H3C – CHI – CH3 + H2O
propan-2-ol 2-jodpropan
R: substituce nukleofilní
Úkol 3:
Jak se oxiduje butan-1-ol a butan-2-ol? Napište rovnici reakce.
CH3 – CH2 – CH2 – CH2(OH) + O2 -> CH3 – CH2 – CH2 – CHO
butan-1-ol butanal
-> CH3 – CH2 – CH2 – COOH
kyselina máselná
CH3 – CH – CH2 – CH3 + O2 -> CH3 – C – CH2 – CH3 + H2O
׀ ׀׀
OH O
butan-2-ol ethylmethylketon
Úkol 4:
Navrhněte přípravu pro propan-2-ol z 1-chlorpropanu. Co vzniká oxidací propan-2-olu?
H2C – CH2 – CH3 -> HCl + CH2 ═ CH – CH3
׀ propen
Cl R1: eliminace
1-chlorpropan
CH2 ═ CH – CH3 + H2O -> CH3 – CH – CH3
׀
OH R2: adice elektrofilní
propan-2-ol
CH3 – CH – CH3 + O2 -> CH3 – C – CH3
׀ ׀׀
OH O R3: oxidace
dimethylketon