Charakteristika
· Kyslíkaté deriváty uhlovodíků, které obsahují alespoň jednu karboxylovou skupinu COOH.
Rozdělení
1) Podle počtu karboxylových skupin: a, monokarboxylové (jednosytné) b, dikarboxylové (dvojsytné)
2) Podle charakteru uhlíkatého řetězce: a, alifatické b, aromatické
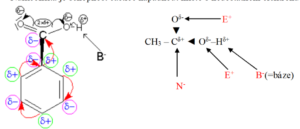
Rozbor struktury
· Bazicita je schopnost částice poutat proton
· Nukleofilita je schopnost částice napadnout místo s nedostatkem elektronů
Názvosloví
1) Název tvoříme příponou –ová (diová), přičemž uhlík karboxylové skupiny je započten do základního řetězce.
CH3COOH kyselina ethanová
2) Uhlíkatý řetězec + karboxylová kyselina, přičemž uhlík karboxylové kyseliny není
započítán do základního řetězce.
benzen karboxylová kyselina
3) Triviální názvosloví (kyselina mravenčí HCOOH)
Vzorce kyselin
Monokarboxylové alifatické kyseliny
1) Kyselina methanová (mravenčí) HCOOH
2) Kyselina ethanová (octová) CH3COOH
3) Kyselina propanová (propionová) CH3CH2COOH
4) Kyselina butanová (máselná) CH3CH2CH2COOH
5) Kyselina pentanová (valerová) CH3(CH2)3COOH
6) Kyselina hexanová (kapronová) CH3(CH2)4COOH
7) Kyselina hexadekanová (palmitová) C15H31COOH
8) Kyselina oktadekanová (stearová) C17H35COOH
9) Kyselina propenová (akrylová) CH2 ═ CHCOOH
10) Kyselina cis-9-oktadecenová (olejová) C17H33COOH
Dikarboxylové alifatické kyseliny
1) Kyselina ethandiová (šťavelová) HOOC – COOH
2) Kyselina propandiová (malonová) HOOC – CH – COOH
3) Kyselina butandiová (jantarová) HOOC – (CH)2 – COOH
4) Kyselina pentadiová (glutarová) HOOC – (CH2)3 – COOH
5) Kyselina hexandiová (adipová) HOOC – (CH2)4 – COOH
Aromatické kyseliny
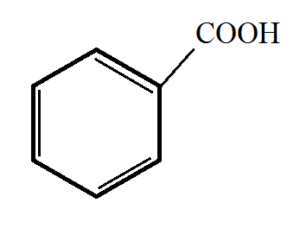
1) Kyselina benzoová (benzenkarboxylová kyselina)
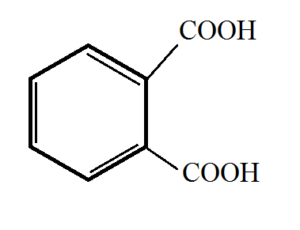
2) Kyselina ftalová (benzen-1,2-dikarboxylová kyselina)
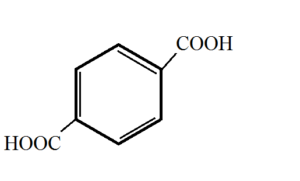
3) Kyselina tereftalová (benzen-1,4-dikarboxylová kyselina)
Vlastnosti
· Nižší (do 3 uhlíků) jednosytné kyseliny jsou ostře páchnoucí kapaliny
· Od 4 – 9 uhlíků jsou nepříjemně páchnoucí olejovité kapaliny
· Od 10 uhlíků výše jsou bezbarvé, pevné látky bez zápachu
· Od 8 uhlíků nerozpustné ve vodě
· Dvojsytné a aromatické kyseliny jsou bezbarvé, krystalické látky pouze částečně rozpustné ve vodě
· Dvojsytné karboxylové kyseliny se rozpouštějí ve vodě lépe než jednosytné se stejným počtem atomů uhlíku v molekule
· Teploty varu jsou vlivem vodíkových můstků vysoké
Výskyt a zdroje
· Nejrozšířenější kyseliny
· Mnohé z nich jsou obsaženy v živých organismech, kde se účastní biochemických reakcí
· Vyskytují se v rostlinách (ovoce, zelenina), při kvasných procesech…
Síla karboxylových kyselin
· Vyjadřuje se stejně jako u anorganických kyselin pomocí disociační konstanty KA
· Podle síly je dělíme na: a, silné – KA > 10-2 b, slabé – KA < 10-2
· U derivátů karboxylových kyselin záleží na navázané skupině
· Alkyly poskytují elektrony → snižují sílu karboxylové kyseliny
· Halogeny elektrony odčerpávají→ zvyšují sílu karboxylové kyseliny
Chemické reakce
1) Neutralizace CH3COOH + NaOH →CH3COONa + H2O (0ctan sodný)
2) Esterifikace – reakce kyseliny a alkoholu za vzniku esteru a vody

benzoová kyselina
methylester kyseliny benzoové
3) Zmýdelnění – opak esterifikace, probíhá za katalýzy zásadou
CH3CH2COOCH3 + KOH →CH3CH2COOK + CH3OH methylester kyseliny propanové
4) Dekarboxylace – reakce, při níž dojde k odštěpení CO2 při zahřívání karboxylových kyselin.
HOOC – CH2 – COOH → CO2 + CH3COOH malomová kyselina octová kyselina
Zástupci
Kyselina mravenčí HCOOH
· Bezbarvá, leptavá, ostře páchnoucí látka
· Vyskytuje se v těle mravenců, včelím jedu, v listech kopřiv
· Má baktericidní a redukční vlastnosti
· Používá se při konzervování, jako dezinfekční prostředek
· Uplatnění v kožedělném průmyslu, kožním lékařství
· Její estery se v potravinářství používají jako vonné přísady
Kyselina octová CH3COOH
· Bezbarvá kapalina, štiplavého zápachu
· Vyrábí se octovým kvašením alkoholu, pro nepotravinářské účely oxidací acetaldehydů
· Nejvýznamnější organická kyselina
· Jeden z nejvýznamnějších metabolitů (acetylkoenzym A)
· Její 8% roztok se běžně prodává pod názvem ocet
· Používá se k výrobě acetátového hedvábí, léčiv a v konzervárenském průmyslu
· Použití jejích esterů v potravinářství
Kyselina máselná CH3CH2CH2COOH
· Olejovitá, nepříjemně páchnoucí kapalina
· Uvolňuje se žluknutím másla
Kyselina šťavelová HOOC – COOH
· Krystalická jedovatá látka
· Vyskytuje se v rostlinách ve formě solí
· Šťavelan vápenatý je základní složkou ledvinových kamenů
· Používá se k přípravě mořidel
Kyselina benzoová
· Bezbarvá, krystalická látka
· Vyrábí se oxidací toluenu
· Pro své antioxidační se používá v kožním lékařství
· Působí jako ochrana proti plísním a kvasinkám ® potravinářský průmysl
Kyselina ftalová a tereftalová
· Bílé, krystalické látky
· Výroba barviv, umělých vláken
Deriváty karboxylových kyselin
· Odvozujeme 2 typy derivátů: a) funkční deriváty b) substituční deriváty
Funkční deriváty
· Odvozují se z karboxylových kyselin, ve kterých dochází k náhradě H, OH, OOH jinou funkční skupinou
· Jsou velmi reaktivní
· Patří zde: a, Soli karboxylových kyselin b, Estery karboxylových kyselin c, Halogenidy d, Amidy e, Anhydridy
Soli
· Vznikají neutralizací karboxylových kyselin
· Atom vodíku karboxylu je nahrazen kovem
· Sodné soli jsou základem tvrdých mýdel, draselné soli mýdel mazlavých CH3COOH + NaOH → CH3COONa + H2O kyselina octová octan sodný HCOOH + NaOH → HCOONa + H2O kyselina mravenčí mravenčan sodný
Octan hlinitý
· Používá se v lékařství na zmírnění otoků
Benzoan sodný
· Používá se jako konzervační prostředek
Soli vyšších mastných kyselin
· Sodné a draselné soli se používají jako mýdla
Estery
· Vznikají esterifikací = reakce alkoholu s organickou kyselinou
· Opak esterifikace se nazývá: a, zmýdelnění – pokud probíhá v alkalickém prostředí b, hydrolýza – pokud probíhá v kyselém prostředí
· Kapalné látky, nerozpustné ve vodě
· Mají charakteristickou vůni
· Mnoho esterů je součástí přírodních esencí
· Estery vyšších mastných kyselin jsou součástí tuků a olejů
· Uplatňují se v potravinářství a při výrobě voňavek CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O
ethylester kyseliny octové
Ethylester kyseliny mravenčí – rumová esence
Ethylester kyseliny octové – hrušková esence
Ethyletser kyseliny máselné – ananasová esence
Dimethylester kyseliny ftalové – používá se do repelentů
Halogenidy
· Kapalné i krystalické látky, ostře páchnoucí
· Velice reaktivní
· Výchozí surovina pro výrobu dalších látek
Amidy
· Kapalné nebo krystalické látky
· Skupina OH je nahrazena skupinou NH2
· Dehydratací amidů vznikají nitrily (CH3C≡N – acetonitril) NH2 / CH3C ═ O
amid kyseliny octové
Anhydridy
· Vznikají dehydratací dvou karboxylových kyselin
· Používají se v organických syntézách jako acylační činidla acetanhydrid
Substituční deriváty
· Odvozují se náhradou jednoho nebo více atomů vodíku v uhlovodíkovém řetězci karboxylové kyseliny jiným atomem nebo funkční skupinou
· Mají podobné vlastnosti jako karboxylové kyseliny, protože karboxylová skupina zůstává zachována
· Patří zde: a, halogenkyseliny b, hydroxokyseliny c, ketokyseliny d, aminokyseliny
Halogenkyseliny
· Krystalické, jedovaté látky leptající pokožku
· Připravují se katalytickou halogenací kyselin nebo adicí halogenvodíku na nenasycené kyseliny
· Přítomnost halogenu zvyšuje sílu kyseliny
· Síla závisí na: a, poloze halogenu → čím je halogen blíže karboxylu, tím je kyselina silnější b, elektronegativitě→ čím je vyšší elektronegativita halogenu, tím je kyselina silnější c, počtu atomů halogenu ® čím vyšší počet, tím větší síla
Kyselina fluoroctová
· Jedovatá
· Obsažena v tropických rostlinách
Kyselina chloroctová
· Má leptavé účinky
· Surovina k organickým syntézám
Kyselina trichloroctová
· Patří mezi nejsilnější kyseliny
· Silně leptavé účinky
· Používá se k hubení plevele a vyleptávání bradavic
Hydroxykyseliny
· Krystalické látky, dobře rozpustné ve vodě
· Připravují se hydrolýzou halogenkyselin
Kyselina uhličitá
· Nejjednodušší hydroxokyselina
· Mezi její deriváty patří: Močovina – bezbarvá, krystalická látka Výroba plastů a léků Fosgen – velmi jedovatý plyn v 1. světové válce jako bojový plyn
Kyselina mléčná
· Vzniká mléčným kvašením cukrů
· Je přítomna v kyselém mléce, při kvašení okurek, v kyselém zelí
· Používá se jako redukční činidlo v barvářství, v koželuhštví k odvápnění kůží
· Konečným produktem anaerobní glykolýzy (ve svalech)
· Existuje její levotočivá a pravotočivá forma (podle polohy hydroxylové skupiny)
· Kvasný průmysl
Kyselina jablečná
· Vyskytuje se v nezralém ovoci
· Jedna z nejrozšířenějších kyselin
Kyselina vinná
· Vyskytuje se v ovoci (volná, nebo jako sůl)
· Přidává se do šumivých a pečících prášků
· Vinan sodný, draselný
Kyselina citrónová
· Vyskytuje se hojně v citrusových plodech
· Připravuje se kvašením cukrů
· Je součástí Krebsova cyklu, je jedním z meziproduktů metabolismu živin
· Dobře rozpustná ve vodě
· Používá se k přípravě nápojů, v cukrářství
· Používá se také ke konzervaci krve
Kyselina salicylová
· Brání růstu mikroorganismů
· Používá se v lékařství, jako konzervační činidlo
· Salicitan sodný – lék proti revmatismu
Kyselina acetylsalicilová
· Acylpyrin, aspirin – lék proti bolestem, horečce a zánětům
Kyselina paraaminosalicilová
· PAS – lék proti tuberkulóze
ortoacetylsalicylová kyselina salicylová aspirin, acylpyrin
Ketokyseliny
· Účastní se biochemických pochodů
Kyselina pyrohroznová
· Je produktem glykolýzy (štěpení cukrů)
