CHEMICKÁ VAZBA
- Soudržné síly, které navzájem poutají sloučené atomy v molekulách a krystalech pomocí valenčních elektronů
Oktetové pravidlo: Atomy vytváří tolik vazeb, aby sdílením elektronů dosáhly stabilní konfigurace vzácného plynu (s2 p6). Elektrony zprostředkující vazbu se počítají do valenční vrstvy obou atomů. Př.: 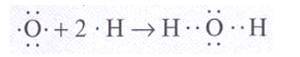
Podmínky pro vznik chemické vazby
- Atomy se přiblíží tak, aby se překrývaly jejich valenční orbitaly
- Elektrony musí být v orbitalech uspořádány tak, aby mohly vzniknout vazebné el. páry (el. mají opačný spin)
- Chemické vazby vznikají a zanikají při chemických reakcích
- Chemická vazba vzniká tehdy, má-li nové seskupení atomů menší energii než jednotlivé atomy
- Podmínkou vzniku vazby je dostatečné přiblížení atomů, které mají dostatečně vysokou energii a správnou prostorovou orientaci
Energie vazeb
- Při tvorbě chemické vazby se uvolňuje vazebná energie
- Pro rozštěpení chemické vazby je nutno dodat tzv. disociační energii
- Tyto dvě energie se liší pouze znaménkem, udávají se v kJ*mol-1
- Čím větší je vazebná energie, tím je vazba pevnější
Vlastnosti chemické vazby
- Délka vazby– vzdálenost středů atomových jader, která jsou vazbou spojena
- Vazebný úhel a prostorové uspořádání vazby– jsou-li vazby rovnocenné a středový atom nemá val. El., jsou vazebné úhly a prostorové tvary následující:
– molekula vody není lineární, ale lomená (kyslík má dva volné el. Páry), vazebný úhel je přibližně 105°
Typy vazeb
KOVALENTNÍ VAZBA
- je založena na společném sdílení dvojic elektronů oběma atomy.
- Elektrony společné oběma atomům, mají opačný spin (podle Pauliho principu)
- Počet kovalentních vazeb vycházejících z atomu prvků ve sloučenině (neboli počet vazebných el. Párů, které sdílí s druhým atomem)= vaznost (Lewis)
- Přiblížením 2 atomů→průnik valenčních el.→ molekulový orbital (podle tvaru molekulové orbitaly: σ a π )
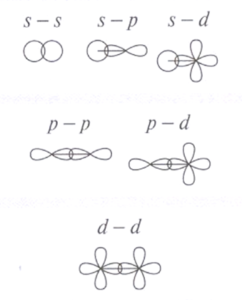
- Vazba σ : vzniká obsazením molekulového orbitalu σ, Hustota je největší na spojnici jader atomů, vzniká překrytím:
- Dvou orbitalů s, sa p nebo s a d
- Dvou orbitalů p nebo p a d
- Dvou orbitalů d
- Vazba π: vzniká obsazením molekulového orbitalu π, elektronová hustota je největší mimo spojnici jader atomů, vzniká až po vzniku vazby σ , podílí se na vzniku násobných vazeb; je slabší, proto sloučeniny s násobnou vazbou jsou reaktivnější; vzniká překrytím:
- Dvou orbitalů p
- Orbitalů p a d
- Dvou orbitalů d
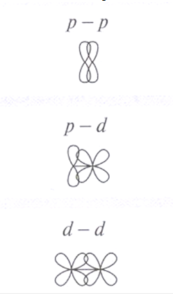
Násobné vazby
- Jednoduchá vazba – vazba uskutečněná sdílením pouze jednoho elektronového páru.
Je tvořena vazbou σ (sigma)
Je delší a slabší než násobné vazby - Dvojná vazba – vazba uskutečněná sdílením dvou elektronových párů.
Je tvořena jednou vazbou σ a jednou vazbou π
Je kratší a pevnější než jednoduchá vazba - Trojná vazba – vazba uskutečněná sdílením tří elektronových párů.
Tvoří ji jedna vazba σ a dvě vazby π
Je nejkratší a nejpevnější
Elektronegativita
- Je schopnost atomu přitahovat vazebné elektrony
- Elektronegativnější atom ve vazbě k sobě poutá elektronový pár silněji než druhý atom
Polarita kovalentní vazby
- Vazba polární – vzniká mezi dvěma různými atomy, kde je rozdíl elektronegativit od 0,4 – 1,7
V okolí atomu s vyšší elektronegativitou je hustota elektronů vyšší, než v okolí druhého ®
U elektronegativnějšího atomu převládá záporný náboj ® molekula má kladný a záporný pól ® molekula tvoří tzv. dipól
- Vazba nepolární – vzniká mezi dvěma stejnými atomy, nebo u atomů, kde rozdíl elektronegativit nepřevyšuje 0,4
Rozdělení elektronové hustoty je přibližně rovnoměrné
Obě jádra přitahují vazebné elektrony stejnou silou.
Iontovost kovalentní vazby- každá vazba je jak polární, tak iontová (př.: ΔX=0,2…vazba je z 1% iontová a z 99% polární
KOORDINAČNĚ KOVALENTNÍ VAZBA
- jeden atom (donor) poskytne oba elektrony, druhý atom (akceptor) má ve valenční vrstvě volný orbital a oba elektrony přijme.
IONTOVÁ VAZBA
- Extrémní případ polární kovalentní vazby
- Rozdíl elektronegativit je větší než 1,7
- Sdílené elektrony patří téměř úplně do el. Obalu elektronegativnějšího atomu
- Elektropozitivnější atom předá elektron druhému atomu →kation a anion
KOVOVÁ VAZBA
- Mezi atomy kovu v tuhém stavu
- Každý atom kovu je v krystalické mřížce obklopen větším počtem stejných atomů, než je počet jeho valenčních elektronů
- Překrytím valenčních elektronů těchto atomů se vytváří energetické pásy (zde lokalizovány spol. elektrony
Vazebné interakce
- Van der Waalsovy síly – vznikají na základě vzájemného působení molekulových dipólů a projevuje se přitahováním opačných pólů molekul nebo nábojů iontů.
- Vodíkový můstek – vyskytuje se u sloučenin vodíku s prvkem o vysoké elektronegativitě a nevazebným elektronovým párem (F, O, N), kde atom vodíku jedné molekuly vytváří slabou vazbu s volným elektronovým párem elektronegativnějšího prvku druhé molekuly
Ve vzorcích ji značíme tečkováním.
Vliv chemické vazby na vlastnosti látek
Látky s kovalentní nepolární vazbou: nerozpustné ve vodě, rozpustné v nepolárních rozpouštědlech, nevedou el. Proud
Látky s polární a iontovou vazbou: rozpustné ve vodě, nerozpustné v nepolárních rozpouštědlech, v tavenině nebo v roztoku vedou el. Proud
Látky s kovovou vazbou: vedou el. Proud a teplo, jsou kujné a tažné
Krystaly
– tvoří je látky, které mají pravidelné uspořádání základních částic (iontů, atomů a molekul)
– geometrické těleso omezené krystalovými plochami, které se stýkají v hranách a ty se sbíhají ve vrcholech
– základní stavební jednotkou=základní buňka (nejjednodušší seskupení částic)
-dělení:
- Iontové krystaly
– složené z iontů, každý ion je obklopen co největším počtem iontů opačně nabitých
– jsou křehké, mají vysoké teploty tání, v roztocích a taveninách vedou el. Proud (př. NaCl)
- Atomové (kovalentní) krysaly
– složené z pravidelně uspořádaných kovalentně vázaných atomů
– vysoké teploty tání, tvrdé, nerozpustné v běžných rozpouštědlech, nevedou el. proud (př. Diamant)
- Molekulové krystaly
– složené z pravidelně uspořádaných molekul
– ty jsou navzájem vázány van der Waalsovými silami nebo vodíkovými můstky
-nízké teploty tání, nevedou el. proud (např.: jód)
KLASIFIKACE CHEMICKÝCH REAKCÍ
- Podle počtu fází
-
- Homogenní reakce – všechny reakční složky tvoří jednu fázi
H2(g) + Cl2(g) ® 2HCl(g) - Heterogenní reakce – reakční složky tvoří různé fáze, reakce probíhají na fázovém rozhraní reaktantů
2 Na(s) + 2H2O(l) ® 2 NaOH(aq) + H2(g)
- Homogenní reakce – všechny reakční složky tvoří jednu fázi
- Podle vnějších změn
- Reakce skladné (syntéza) – z jednoduchých reaktantů vznikají složitější produkty.
NH3 + HCl ® NH4Cl - Reakce rozkladné (analýza) – složitější reaktanty se štěpí na jednodušší produkty.
CaCO3 ® CaO + CO2 - Substituční reakce – atom nebo skupina atomů je nahrazena za jiný atom nebo jinou skupinu atomů
Zn + CuSO4 ® ZnSO4 + Cu - Podvojná záměna – vzniká spojením dvou substitučních reakcí
NaCl + AgNO3 ® NaNO3 + AgCl
- Reakce skladné (syntéza) – z jednoduchých reaktantů vznikají složitější produkty.
- Podle vazebných změn
- Adice – reakce, při níž se na organickou sloučeninu nesoucí násobnou vazbu přidávají (adují) molekuly jiné látky (halogenvodíků, vody) a násobná vazba zaniká.
CH2 ═ CH2 + Cl2 ® CH2Cl – CH2Cl
Elektrofilní adice – převážně u adic halogenů a halogenvodíků na alkeny a alkiny
Nukleofilní adice – typická pro karbonylové sloučeniny - Eliminace – reakce, při níž dochází k odštěpení jednoduché anorganické sloučeniny a současně se vytvoří násobná vazba.
CH3 – CH2Cl ® CH2 ═ CH2 + HCl - Substituce – reakce, při níž je atom nebo skupina atomů zaměněna za jiný atom nebo skupinu atomů.
Násobnost vazby se nemění
radikálová substituce – charakteristická pro sloučeniny s nepolárními kovalentními vazbami (alkany), dochází k homolitickému štěpení vazeb a vznikají radikály
elektrofilní substituce – typická pro aromatické uhlovodíky
Nukleofilní substituce – nukleofilní činidlo reaguje s uhlíkovým atomem s částečně kladným nábojem (alkylhalogenidy) - Přesmyk – izomerační reakce, při níž dochází k přeskupení atomů uvnitř molekuly.
- Adice – reakce, při níž se na organickou sloučeninu nesoucí násobnou vazbu přidávají (adují) molekuly jiné látky (halogenvodíků, vody) a násobná vazba zaniká.
- Podle přenášených částic
- Oxidačně-redukční (redoxní) – reakce, při níž dochází k přesunu elektronů mezi reakčními složkami.
Určité atomy se oxidují a současně jiné atomy se redukují.
Oxidace – zvyšování oxidačního čísla
Redukce – snižování oxidačního čísla
- Oxidačně-redukční (redoxní) – reakce, při níž dochází k přesunu elektronů mezi reakčními složkami.
- Acidobazické (protolitické) – reakci, při níž dohází k výměně vodíkových protonů.
Látky odštěpující kation H+ nazýváme kyseliny
Látky přijímající kation H+ nazýváme zásady
HNO3 + KOH ® H2O + KNO3
kyselina zásada kyselina zásada - Koordinační(komplexotvorné) – reakce, při níž dochází k přenou celých skupin atomů a vzniku koordinačních (komplexních) sloučenin.
CuSO4 + 4 H2O ® [Cu (H2O)4]SO4
