Biochemické děje
Charakteristické vlastnosti
· Metabolismus – soubor chemických procesů, které probíhají v organismu
· Produkt jedné reakce se stává substrátem následující reakce (metabolické dráhy)
Rozdělení metabolických drah
1) Anabolické (syntetické)
· Dráhy, při kterých z jednoduchých látek vznikají látky složitější
· Syntéza glukosy, mastných kyselin, lipidů, bílkovin…
· Podle anabolických procesů dělíme organismy na: a) Autotrofní – umí si syntetizovat všechny organické látky b) Heterotrofní – nejsou schopny syntézy některých látek Některé organické látky musí přijímat z vnějšího prostředí
2) Katabolické (rozkladné)
· Ze složitých substrátů vznikají jednodušší produkty
· Rozklad škrobu na glukosu, bílkovin na aminokyseliny…
3) Amfibolické
· Spojují se jak anabolické, tak i katabolické děje
· Citrátový cyklus
Energetické potřeby organismu
a) Chemické práce
· Buňky syntetizují různé organické látky s vysokým obsahem energie
· Endergonické reakce → spotřebovávají energii
b) Mechanická práce
· Pohyb svalů a chromozomů při dělení buněk
· Pulsování srdce
c) Osmotická a elektrická práce
· Buňky vykonávají práci, aby udržely nerovnovážné rozložení částic ® aktivní transport
· Bioelektrické jevy: vedení nervového vzruchu, činnost orgánů rejnoků, úhořů
d) Světelná práce
· Řada živočichů (světlušky) užívá světélkování k nitrodruhové komunikaci nebo k odpuzování živočichů
e) Informační a regulační práce
· Značná energie se vynakládá na syntézu látek, které udržují biochemické procesy pod kontrolou
f) Teplo
· Při každých endergonických procesech se část energie přeměňuje na teplo
· Často organismus odvádí nadbytečné teplo do okolí
ATP (adenosintrifosfát)
· Aby mohly endergonické procesy probíhat, musí být spojeny s procesem opačným exergonickým, při kterém se energie uvolňuje štěpením ATP
· ATP je makroergní sloučenina, která má vysokoenergetické vazby
· Štěpením těchto vazeb se uvolňuje energie, která se dále využívá
Základní metabolické modely
· Organismy mohou využívat buď energii světelnou, nebo chemickou
1) fotoautotrofní – zachycují světelnou energii a přeměňují ji na energii chemickou, uloženou v ATP → fotosyntéza
2) chemoorganotrofní – pomocí svých enzymových systémů rozloží látky přijaté z okolí a uvolněnou energii ukládají do ATP → katabolismus a) anaerobní – nevyžadují přítomnost kyslíku b) aerobní – vyžadují přítomnost kyslíku
Katabolismus aerobních chemoorganotrofů
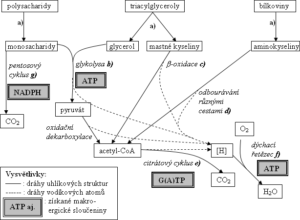
1.Fáze – trávení
· Hydrolytické štěpení živin
· Probíhá v trávicím ústrojí jako mimobuněčný proces
· Reakce jsou katalyzovány trávicími enzymy a do krevního řečiště jsou převáděny molekuly stavebních jednotek, které vstupují do tělních buněk
2. Fáze – štěpení
· Všechny stavební jednotky jsou postupně štěpeny až na aktivovanou formu kyseliny octové = acetylkoenzym A
· Dochází k odštěpování vodíku, vzniká aktivní vodík, který se využívá v anabolických redukcích nebo v dýchacím řetězci
Aktivní vodík
· Značí se [H]
· Vodík trvale koluje mezi látkami a účastní se oxidačně-redukčních procesů
· Je vázán na oxidoreduktasy
· Slouží jako redukční činidlo v anabolických procesech a jako palivo při buněčném dýchání
3.Fáze – citrátový cyklus
· Zbytek kyseliny octové vázaný na koenzym A se v citrátovém cyklu přemění na CO2 a atomy aktivního vodíku, které jsou navázané na oxidoreduktasy
4. Fáze – dýchací řetězec
· Do dýchacího řetězce vstupuje kyslík, který na sebe váže aktivní vodík, čímž regeneruje oxidoreduktasy a syntetizuje ATP
Význam katabolických procesů
1) Dodávají ATP pro všechny endergonické děje
2) V průběhu postupného odbourávání živin vznikají meziprodukty, které slouží anabolickým procesům
3) Aktivní vodík je využíván pro všechny reakce anabolismu
Enzymologie
· Věda zabývající se problematikou biokatalyzátorů
· Buňka má pro každou reakci specifický katalyzátor = enzym
Charakteristika enzymů
· Bílkoviny, které katalyzují všechny reakce probíhajících v živých organismech
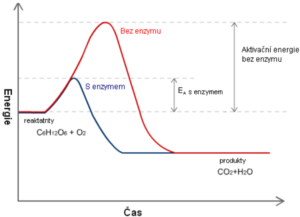
· Urychlují průběh biochemických reakcí snižováním aktivační energie
Požadavky na biokatalyzátory
a) Musí účinně snižovat aktivační energii Z reakce musí vystupovat nezměněné
b) Specifita účinku – každý enzym je specifický pro určitou reakci
c) Substrátová specifita – enzym je schopen preferovat určitý substrát (látka vstupující do reakce) buď: 1) absolutně 2) skupinově
d) Enzymy musí být schopny regulovat účinnost reakce (rychlost, jakou reakce bude probíhat)
Struktura enzymů
· Enzymy rozdělujeme na: a) jednosložkové – tvoří je pouze bílkovina b) dvousložkové – tvoří je komplex (holoenzym)
· Holoenzym se skládá z: 1) Apoenzymu – bílkovinná složka 2) Kofaktoru – nebílkovinná složka: a) koenzym b) prostetická skupina
· Aktivní místo enzymu je část molekuly, na kterou se naváže substrát a kde se realizuje vlastní katalytický děj
· – vznikne enzym-substrátový komplex
· Koenzym se váže na aktivní centrum spolu se substrátem a je složkou enzym-substrátového komplexu
· Jeden koenzym může být pro více enzymů stejný
· Prostetická skupina je vázána pevně na enzym, koenzym bývá volně obsažen v buňce
Kinetika enzymových reakcí
Klasifikace a názvosloví enzymů
1) Oxidoreduktázy – katalyzují oxidačně-redukční přeměny
2) Transferasy – patří mezi složené bílkoviny, účastní se přesunu skupin
3) Hydrolasy – štěpí vazby vzniklé kondenzací za odštěpení vody a) proteasy – štěpí peptidické vazby b) glykosidasy – štěpí glykosidické vazby c) lipasy – štěpí tuky
4) Lyasy – katalyzují nehydrolytické štěpení vazeb
5) Izomerasy – katalyzují vnitromolekulové přesuny atomů a jejich skupin
6) Ligasy – katalyzují vznik energeticky náročných vazeb
Použití enzymů
1) Příprava potravin a nápojů (sýry, kynutá těsta, alkoholické nápoje)
2) Výroba piva
3) Prací a mycí prostředky (štěpí bílkoviny a lipidy)
4) Analytická chemie
Regulace enzymové aktivy
Rychlost enzymových reakcí
a) Množství substrátu – rychlost katalyzované reakce vzrůstá s koncentrací substrátu tak dlouho, dokud se neobsadí všechna aktivní centra enzymu
b) Množství enzymu – rychlost reakce se zvyšuje přímo úměrně množství enzymů za předpokladu dostatečné zásoby substrátu
c) pH prostředí – enzymy mají optimální oblast pH v níž je jejich účinnost nejvyšší
d) Teplota prostředí – Se zvyšující teplotou roste rychlost reakce, ale pouze v rozmezí 10-40°C
Inhibice enzymů
· Kompetitivní inhibice – Inhibitor je podobný substrátu zabraňuje vytvoření komplexu enzym-substrát
· Nekompetitivní inhibice – Nevratný typ inhibice
Inhibitor se naváže na enzym mimo aktivní centrum, čímž vyvolá změnu struktury enzymu ® dochází ke zrušení možnosti vazby substrátu na enzym
Aktivace enzymů
· Katalytickou účinnost zvyšují hořečnaté kationty
· K aktivaci může dojít i tak, že se neúčinná forma proenzym přemění na formu účinnou
