Charakteristika karboxylových kyselin
· Kyslíkaté deriváty uhlovodíků, které obsahují alespoň jednu karboxylovou skupinu COOH
· Odvozujeme 2 typy derivátů: a) funkční b) substituční
· Funkční – dochází k nahrazení H, OH nebo OOH v karboxylové skupině jiným atomem nebo funkční skupinou
· Substituční – dochází k nahrazení jednoho či více atomů vodíku v uhlíkatém řetězci jiným atomem nebo funkční skupinou
Aminokyseliny
Charakteristika
· Substituční deriváty karboxylových kyselin, které mají jeden nebo více atomů vodíku v řetězci nahrazen skupinou NH2
Důsledky nahrazení
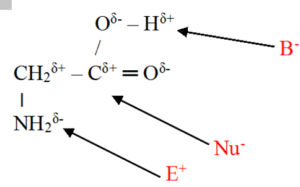
· V karboxylu organické kyseliny je skupina OH nositelkou kyselosti
· Kyselina je dárcem protonu ® skupina OH je schopna odštěpovat proton
· V aminné skupině NH2 je na dusíku volný elektronový pár, který je schopen vázat na sebe proton ®
· Aminná skupina NH2 je centrem zásaditosti
Rozbor struktury
Názvosloví
1) Systematické – skupina NH2 je vyjádřena předponou amino- a její poloha je označena: a) čísly, kde číslujeme od uhlíku karboxylu
b) písmeny řecké abecedy, kde číslování začíná vedle od uhlíku karboxylu.
2) Triviální – s příponou -in
Kódované aminokyseliny
· Kódované aminokyseliny jsou kyseliny, jejichž zabudovávání do bílkovin je řízeno genetickým kódem
· V bílkovinách se jich vyskytuje pouze 20
· Všechny kromě glycinu jsou chirální
Chirální molekuly
· Jsou takové molekuly, které nejsou totožné se zrcadlovým obrazem ® nemají rovinu ani střed souměrnosti
· Poznáme je podle toho, že na každé vazbě uhlíku je jiná skupina
· Vykazují optickou aktivitu a jejich roztoky stáčejí rovinu polarizovaného světla
· Existují D a L formy (L-formy jsou nejběžnější)
Rozdělení aminokyselin
Podle významu pro výživu člověka
a) Esenciální – nepostradatelné, organismus si je nedovede sám připravit ® musí být obsaženy v potravě valin, leucin, fenylanin
b) Neesenciální – postradatelné glycin, alanin, prolin
Podle charakteru postranního řetězce aminokyseliny
a) Nepolární – postranní řetězec obsahuje pouze nepolární zbytky (alkyly) glycin, alanin, valin
b) Polární neutrální – ve vodném roztoku nesou náboj jsou neutrální – mají 1 aminnou a 1 karboxylovou skupinu tyrosin, serin glutamin
c) Kyselé aminokyseliny – musí mít více karboxylových center (2 karboxylové a 1 aminnou) asparágová, glutamová
d) Zásadité aminokyseliny – musí mít více zásaditých center (2 aminné a 1 karboxylovou)
Chování aminokyselin v kyselém prostředí
· V kyselém prostředí dojde k navázání kationtu vodíku na skupinu NH2.
· Přibližně při pH = 2 jsou všechny aminokyseliny ve formě kationtů
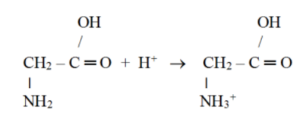
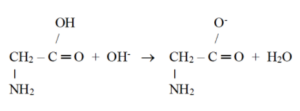
Chování aminokyselin v zásaditém prostředí
· V zásaditém prostředí dojde k odštěpení vody
· Pro pH = 9-10 jsou všechny aminokyseliny ve formě aniontů
Chování aminokyselin v neutrálním prostředí
· V neutrálním prostředí dochází k vnitřní disociaci
· Kationt vodíku se naváže na volný elektronový pár dusíku v aminné skupině
· Vznikne obojaký (amfoterní) iont

Izoelektrický bod
· Je hodnota pH, při které se aminokyseliny chovají neutrálně = všechny její molekuly jsou ve formě amfiontů – obojakých iontů
· Aminokyseliny mají různou hodnotu izoelektrického bodu, který závisí na počtu skupin –COOH a –NH2 v molekule
Peptidy
Charakteristika
· Vznikají kondenzací dvou nebo více molekul aminokyselin.
· Reagují spolu karboxylová skupina jedné kyseliny s aminnou skupinou druhé aminokyseliny.
· Dojde k odštěpení vody a vzniku peptidické vazby.
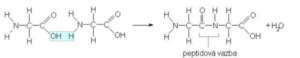
· Postupnou kondenzací vznikají dipeptidy, tripeptidy atd.
Důkaz peptidové vazby
· Biuretová rekce – peptidy tvoří s mědnatými ionty (CuSO4) v alkalickém prostředí (NaOH) modrofialovou komplexní sloučeninu
Bílkoviny
Charakteristika
· Základní stavební jednotky živé hmoty, přítomné ve všech buňkách
· Bílkoviny (proteiny) patří mezi biopolymery
Funkce bílkovin
Stavební funkce
· Převážně nerozpustné bílkoviny fibrilárního (vláknitého) tvaru
· Tvoří základní materiál mimobuněčných struktur
· Obsaženy v chrupavkách, kostech, nehtech…
· Kolageny, elastiny – elastické vazivo
· Keratiny (kůže, vlasy, rohy), Fibrom (hedvábí)
Transportní a skladovací funkce
· Je založena na vratné vazbě převážně nízkomolekulárních látek
· Hemoglobin, myoglobin – zajišťují přenos molekulárního kyslíku v těle
· Transferin – transportuje železné ionty
· Feritin – váže zásobní železo ve slezině
· Sérový albumin – váže a přenáší nízkomolekulární molekuly a ionty
Bílkoviny zajišťující pohyb
· Podílejí se na přeměně chemické energie na mechanickou práci
· Svalové bílkoviny (myozin, tropomyozin, aktin)
Katalytická, řídící a regulační funkce
· Enzymy, které ovlivňují rychlost všech biochemických reakcí
· Insulin, hormony předního laloku hypofýzy.
Obranná a ochranná funkce
· Zajišťují obranu proti cizím buňkám, které pronikly do jejich vnitřního prostředí
· Fibrinogen (ochranná funkce), imunoglobin (obranná funkce)
Struktura
Primární struktura
· Udává pořadí aminokyselin v polypeptidovém řetězci
· Toto pořadí je pro každého jedince specifické
· Je zakódováno ve struktuře DNA
Sekundární struktura
· Je dána geometrickým uspořádáním bílkovinných řetězců
· Existují 2 základní sekundární struktury: a) pravotočivá šroubovice (α-helix) b) skládaný list – vzniká vlivem slabých vazebných sil mezi skupinami CO a NH
Terciální struktura
· Představuje prostorové uspořádání α-helixu a skládaného listu
· Na této struktuře se podílí vodíkové můstky, disulfidové a iontové vazby
· Prostorová struktura molekuly může být: a) fibrilární (vláknitá) b) globulární (klubkovitá)
Kvartální struktura
· Je u bílkovin složených z několika peptidových podjednotek
· Např. hemoglobin, enzymy
Rozdělení bílkovin
Jednoduché
Globulární
· Bílkoviny s kulovitou strukturou
· Rozpustné ve vodě a v roztocích soli
· Patří zde: a) Albuminy – vyskytují se v krevním séru, mléce, vaječném bílku jsou zdrojem aminokyselin b) Globuliny – doprovázejí albuminy podílejí se na obranyschopnosti organismu (γ-globulin)
c) Histony – vyskytují se spolu s nukleovými kyselinami v buněčném jádře nesráží se teplem
Fibrilární
· Bílkoviny s vláknitou strukturou
· Nerozpustné ve vodě
· Stavební materiál živočišných organismů
· Patří zde: a) Kolagen – obsažen v kůži, šlachách, chrupavkách, kostech tvoří 1/3 všech bílkovin v živočišných organismech b) Keratin – je součástí vlasů, nehtů, kůže, peří, kopyt
Složené
a) Fosfoproteiny – obsahují vázanou kyselinu fosforečnou
b) Glykoproteiny – obsahují vázaný cukr
c) Hemoproteiny – obsahují barevnou složku (hemoglobin)
d) Metaloproteiny – obsahují kovy, které přenášejí nebo uskladňují (transferitin)
e) Nukleoproteiny – složka buněčných jader vázána na nukleovou kyselinu
f) Lipoproteiny – obsahují lipidy, podílejí se na stavbě membrán
Denaturace bílkovin
Nevratná (ireverzibilní)
· Dochází k hlubším změnám v molekule bílkoviny, které vedou ke ztrátě charakteristických vlastností, ale nejsou zrušeny peptidické vazby
· Způsobují ji: kyseliny, zásady, soli těžkých kovů (CuSO4, AgNO3, HCl), vyšší teplota
· Uplatňuje se při sterilizaci nástrojů teplem a při uchovávání potravin
· Tepelně zpracované bílkoviny jsou lépe stravitelné a jejich hodnota je zachována
· Při nízké teplotě se uchovávají krevní konzervy
Vratná (reverzibilní)
· Přidáním soli (NaCl) nebo Na2SO4, (NH4)2SO4 dochází ke ztrátě vodného obalu bílkovin a bílkovina se vysolí
· Po přidání vody se bílkovina opět rozpustí

