REAKČNÍ KINETIKA
Studuje rychlost chemických reakcí, závislost na reakčních podmínkách a vysvětluje reakční mechanismus (= soustava jednoduchých reakcí, které vedou od výchozích látek k produktům).
Rozdělení reakcí:
- Izolované – probíhají v soustavách samy.
- Simultánní – v soustavě probíhá současně několik reakcí:
- Zvratné: ve stejném okamžiku vznikají z reaktantů produkty a naopak.Příklad: H2 + I2 → 2HI
- Paralelní: společné reaktanty reagují za vzniku různých produktů.
- Následné: produkt se stává reaktantem následující reakce.
Reakční rychlost
Úbytek látkového množství některého z reaktantů nebo přírůstek látkového množství produktů za jednotku času, dělený stechiometrickým koeficientem této látky.
Faktory ovlivňující reakční rychlost
1. Koncentrace
Rychlost reakce je přímo úměrná součinu koncentrací výchozích látek.
Kinetická rovnice: v = k[A]a[B]b, kde A a B jsou výchozí látky, k je rychlostní konstanta (závislá na teplotě).
2. Teplota
Rychlost chemických reakcí roste s teplotou.
Zvýšením teploty o 10°C se zvýší rychlost reakce obvykle dvakrát až čtyřikrát.
Arrheinova rovnice = závislost rychlostní konstanty na teplotě:
- k – rychlostní konstanta
- předexponenciální faktor
- EA – aktivační energie
- R – univerzální plynová konstanta (8,314 J*K-1*mol-1)
- T – absolutní teplota
- e – základ přirozeného logaritmu, e = 2,718
Van’t Hoffovo pravidlo – zvýšením teploty o 10°C za konstantního složení směsi se rychlost zvýší 2-4x.
3. Katalyzátor
- Katalýza = ovlivňování rychlosti chemické reakce katalyzátorem.
- Katalyzátor = látka, která zvyšuje rychlost chemické reakce, ale sama se reakcí nemění, píše se nad nebo pod šipku.
- Katalýza:
- a) homogenní – reaktanty i katalyzátor jsou ve stejné fázi
- b) heterogenní – reaktanty a katalyzátor jsou v různé fázi
- Rozdělení katalyzátorů:
- Pozitivní – snižují EA a reakční rychlost zvyšují.
- Negativní (inhibitory) – zvyšují EA a reakční rychlost snižují.
- Stabilizátory – zastavují řetězovou reakci.
- Katalytické jedy – zabraňují působení katalyzátorů.
- Katalyzované reakce: probíhají jiným reakčním mechanismem než reakce nekatalyzované, aktivační E katalyzované reakce je menší než aktivační E reakce bez katalyzátoru.
- Katalyzátor vytvoří s reaktantem meziprodukt, ten reaguje s druhým reaktantem → vznikne produkt a katalyzátor se uvolní.
- A + K → AK
- AK + B → C + K
4. Tlak
Uplatňuje se u reakcí v plynové fázi.
Stavová rovnice plynů: V = R*T/p
Teorie reakční kinetiky
Srážková teorie
Předtím, než spolu částice zreagují, musí se srazit. Aby byla srážka účinná, musí mít částice v okamžiku srážky vhodnou prostorovou orientaci a dostatečně velkou energii (aktivační E – je rovna E potřebné k rozštěpení vazeb v reaktantech). Tato teorie byla překonána teorií aktivovaného komplexu.
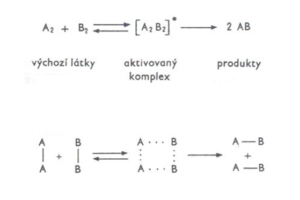
Teorie Aktivovaného komplexu
Při uskutečnění účinné srážky vytvoří reagující částice nejprve tzv. aktivovaný komplex, který je charakterizován určitou hodnotou aktivační energie EA (je určena rozdílem vnitřní energie aktivovaného komplexu a vnitřní energie výchozích látek).
Aktivovaný komplex
- Je nestálý celek, který vzniká vytvořením nových vazeb mezi atomy různých molekul.
- V průběhu reakce se buď zcela přeruší původní zesláblé vazby a vytvoří se vazby nové (produkty), nebo se aktivovaný komplex rozpadne zpět na výchozí látky.
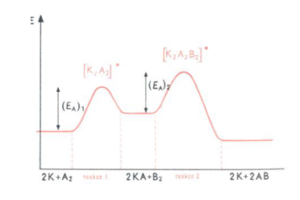
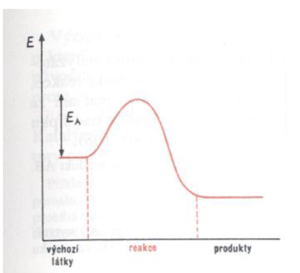
Obr.: Změny E částic v průběhu reakce
TERMOCHEMIE
- Zabývá se tepelnými změnami při chemických reakcích.
- Teplo, které se při reakci uvolní či spotřebuje, závisí na:
- druhu reaktantů a produktů,
- množství a skupenství látek,
- způsobu, jakým reakce probíhá.
Reakční teplo Qm
- Veličina, která udává teplo, které systém při reakci přijme od okolí, pokud se dané reakce účastní takové látkové množství reaktantů, které odpovídá jejich stechiometrickým koeficientům.
- Probíhá-li za konstantního objemu, pak Qm = ΔU (dodané teplo se spotřebuje na zvýšení vnitřní energie).
- Probíhá-li za konstantního tlaku, pak Qm = ΔH (entalpie), dodané teplo se spotřebuje na zvýšení entalpie.
Reakce endotermické a exotermické
- Vychází z termodynamického zákona.
- Každá chemická reakce je provázena změnou chemické energie.
- Podle tepelné bilance rozdělujeme reakce na:
- endotermické – teplo se spotřebovává (∆H > 0); energie produktů je vyšší než energie reaktantů.
- exotermické – teplo se uvolňuje (∆H < 0); energie produktů je nižší než energie reaktantů.
- ∆H = entalpie (vnitřní teplo) = změna energie.
- ∆H = konečný stav – výchozí stav.
Termochemické zákony
-
- Termochemický zákon (Lavoisier, Laplace):
- Hodnota reakčního tepla přímé a zpětné reakce je stejná, liší se pouze znaménkem.
- Termochemický zákon (Lavoisier, Laplace):
Příklad:
- Termochemický zákon (Hess):
- Reakční teplo určité reakce je stejné jako součet reakčních tepel postupně prováděných reakcí, vycházejících ze stejných výchozích látek a končících stejnými produkty.
Teplo slučovací a spalné
Slučovací teplo sloučeniny – reakční teplo reakce, při níž z prvků ve standardním stavu vznikne jeden mol této sloučeniny ve standardním stavu; jsou stanovena především pro sloučeniny anorganické.
Spalné teplo sloučeniny – reakční teplo reakce, při níž se jeden mol této sloučeniny ve standardním stavu zoxiduje na konečný oxidační produkt; stanoveno především pro organické sloučeniny.
- Reakční teplo reakce můžeme spočítat jako rozdíl součtu slučovacích tepel reakčních produktů a součtu slučovacích tepel výchozích látek.
- Reakční teplo můžeme spočítat jako rozdíl součtu spalných tepel reakčních výchozích látek a součtu spalných tepel produktů.
Chemická rovnováha
- Stav, ve kterém chemická soustava nemění dále své složení, pokud se nezmění vnější podmínky, i když v ní probíhají chemické děje.
- Účinky těchto dějů se navzájem ruší; ustavená rovnováha je dynamická rovnováha:
- Pokud jsou na počátku v soustavě jen výchozí látky, je rychlost přímé reakce v1 větší než rychlost reakce zpětné v2.
- V průběhu reakce se rychlost přímé reakce v1 zmenšuje a naopak vzrůstá rychlost zpětné reakce v2.
- Ve chvíli, kdy se rychlost obou reakcí vyrovnají (v1 = v2), je výsledná rychlost nulová a soustava dosáhne rovnováhy.
- Ustavuje se v soustavách látek, kde probíhají zvratné reakce.
Rovnovážná konstanta
- Je dána podílem součinu rovnovážných koncentrací produktů a součinů rovnovážných koncentrací výchozích látek umocněnými stechiometrickými koeficienty.
- Kde k1 a k2 jsou rychlostní konstanty.
- Pokud je Kc > 104, tak proběhla prakticky úplná přeměna (výchozí látky jsou přeměněny v produkty).
- Pokud je Kc < 104, tak reakce téměř neprobíhá.
Odvození Guldberg-Waagova zákona:
- Rychlost přímé reakce: v1 = k1[A]a[B]b
- Rychlost zpětné reakce: v2 = k2[C]c[D]d
| k1 | = | [C]g.[D]d |
| k2 | = | [A]a.[B]b |
Činitelé ovlivňující chemickou rovnováhu
- Vnějším zásahem (akcí) je vyvolán děj (reakce), který vede ke zrušení účinku tohoto vnějšího zásahu.
- Chemickou rovnováhu můžeme ovlivnit:
- a) změnou tlaku,
- b) změnou teploty,
- c) změnou koncentrace.
Tlak
- Je-li látkové množství plynných látek větší na straně produktů, snížení tlaku vede ke zvýšení koncentrace produktů. (Příklad: N2O4 ® 2 NO2)
- Je-li látkové množství plynných látek větší na straně výchozích látek, zvýšení tlaku vede ke zvýšení koncentrace produktů. (Příklad: 3 H2 + N2 ® 2 NH3)
- Je-li látkové množství stejné, tak tlak chemickou rovnováhu neovlivňuje. (Příklad: 2 HI ® I2 + H2)
Koncentrace
- Snížením koncentrace produktů dojde k dalšímu reagování výchozích látek za vzniku dalších produktů, takže reakce proběhne úplněji.
- Zvýšením koncentrace výchozích látek dojde ke vzniku nových produktů za účelem nastolení opětovné rovnováhy.
Teplota
- Zvyšování teploty podpoří reakci, při níž se teplo spotřebovává – endotermická reakce.
- Snižování teploty podpoří reakci, při níž se teplo uvolňuje – exotermická reakce.