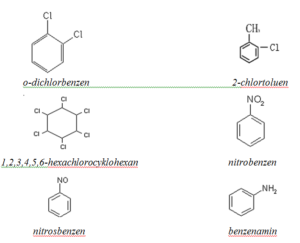
Deriváty uhlovodíků
- V molekule uhlovodíku je nahrazen vodíkový atom nebo vodíkové atomy jiným prvkem nebo charakteristickou skupinou
- Rozdělení derivátů uhlovodíků:
- Halogenové – halogenidy
- Kyslíkaté – alkoholy, fenoly, karbonylové, karboxylové sloučeniny a jejich deriváty
- Dusíkaté – nitrosloučeniny, aminoslučeniny, azo- a diazosloučeniny
- Sirné – thioly, sulfidy, sulfonové kyseliny
Halogenderiváty
Charakteristika
- Halogenové deriváty vznikají náhradou jednoho nebo více vodíkových atomů v molekule uhlovodíku halogenem (F, Cl,…)
Názvosloví
- Připojujeme předponu s počtem a druhem halogenu
- Kromě systematických názvů se používají i názvy triviální (chloroform, jodoform)
CH3 – CH2 – Cl CH2Br – CH2Cl CHI3
chlorethan 1-brom-2-chlorethan trijodmethan, jodoform
Příprava
- Z alkanů radikálovou substitucí (chlorace methanu)
- Z alkenů a alkynů elektrofilní adicí
- Z aromatických uhlovodíků elektrofilní substitucí
Vlastnosti
- Halogenderiváty s malou relativní hmotností jsou plyny, ostatní jsou kapaliny nebo pevné látky.
- Většina má narkotické účinky
- Mnohé jsou slzotvorné
- Zdraví škodlivé, jedovaté
- Patří mezi kumulované jedy = jsou rozpustné v tucích ® ukládají se a hromadí v tělních tkáních
Základní reakce
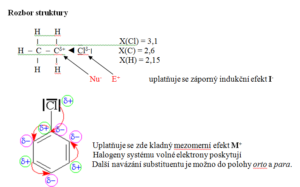
Nukleofilní substituce
- Nukleofilní činidlo napadá částečně kladně nabitý atom uhlíku
- Vznikají tak alkoholy, ethery, estery, thioly, sulfidy…CH3Br + KOH -> CH3OH + KBrC6H5Cl + NaOH -> C6H5OH + NaCl
benzylchlorid
Eliminace
- Eliminací vznikají z halogenderivátů alkeny za odštěpení halogenvodíkuCH3–CH2–CHBr–CH3 -> CH3–CH═CH–CH3 + HBr
2-brombutan but-2-en
Použití
- Rozpouštědla v průmyslu
- Chladící kapaliny (freony)
- Izolační materiály (snižují hořlavost)
- Základní složka různých postřiků (fungicidů, herbicidů, pesticidů)
- Součástí řady léčiv (analgetika, sedativa)
- Výroba makromolekulárních látek (PVC, teflon, bojové chemické látky)
Zástupci
Chlormethan CH3Cl
- Plyn používající se k organickým syntézám
- Prostředek proti hmyzu
- Používá se k plnění chladících zařízení
Trichlormethan CHCl3
- Chloroform
- Těkavá kapalina (var 61°C)
- Nasládlý zápach, nehořlavá
- Výborné rozpouštědlo
- Používá se k organickým syntézám
- Dříve jako totální anestetikum (pro své karcinogenní účinky se nepoužívá)
- Na světle se rozkládá na jedovatý fosgen (CCl2O)
Tetrachlormethan CCl4
- Těkavá, jedovatá, karcinogenní kapalina
- Používá se jako rozpouštědlo
- Dříve náplň do hasících přístrojů
Tribrommethan CHBr3
- Bromoform
- Používá se k organickým syntézám
- Výroba prostředku proti kašli
Trijodmethan CHI3
- Jodoform
- Pevná látka
- Tvoří světle žluté krystalky
- Má dezinfekční účinky
Chlorethan CH3CH2Cl
- Využívá se k povrchovému umrtvování v lékařství
Tetrafluorethylen CF2 ═ CF2
- Polymeruje na polytetrafluorethylen = teflon
- Teflon – velmi tepelně odolný
Vinylchlorid CH2 ═ CHCl
- Polymeruje na polyvinylchlorid PVC
- Používá se ve 2 formách:
a) neměkčený = novodur (používá se na trubky)
b) měkčený = novoplast (PVC)
náhražka gumy a kůže
Trichlorethylen CHCl ═ CCl2
- Bezbarvá kapalina
- Velice dobrý čistící prostředek a rozpouštědlo
- Páry jsou jedovaté
- Čikuli – čistič vhodný k odstranění zbytků lepidla
Chloropren H2C ═ C – CH ═ CH2
׀
Cl
- Surovina pro výrobu chloroprenového kaučuku
Hexachlorocyklohexan C6H6Cl6
- Používá se jako insekticid v zemědělství, v lesnictví (proti kůrovci)
Chlorbenzen C6H5Cl
- Bezbarvá kapalina
- Slouží k výrobě aromatických sloučenin (fenolů)
- Výchozí látka pro výrobu DDT
- DDT – patří mezi kumulativní jedy
léčí malárii
u nás výroba zakázána roku 1974.
Paradichlorbenzen
- Je součástí přípravků proti molům
Freony
- plynné halogenalkany obsahující v molekule atomy Cl a F
- Slouží jako náplně do chladících zařízení a hnací plyny ve sprejích
- Jsou velmi stabilní -> rozkládají se za velmi dlouhou dobu
- Unikají do atmosféry, kde působením UV záření se z molekuly uvolňuje chlórový radikál, která napadá molekulu ozonuCl∙ + O3 -> ClO + O2
- Jejich výroba se omezuje
- Každý freon je označen 3 číslicemi: číslice – počet atomů uhlíku freonu zmenšený o 1
2. číslice – počet atomů vodíku freonu zvětšený o 1
3. číslice – počet fluorových atomů nezvětšen
Dusíkaté deriváty
Charakteristika
- Obsahují ve svých molekulách vazbu C – N
- 4 základní skupiny:
1) Aminy
2) Nitrosloučeniny
3) Azosloučeniny
4) diazoniové soli
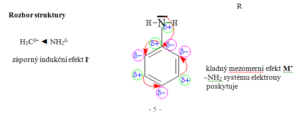
Aminy
Charakteristika
- Aminy jsou deriváty amoniaku, ve kterém jsou 1, 2 nebo 3 vodíky nahrazeny uhlovodíkovým zbytkem
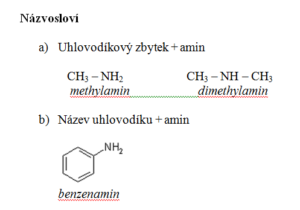
- Dělení aminů:
1, primární – vznikají náhradou 1 atomu vodíku R – NH2
2, sekundární – vznikají náhradou 2 atomů vodíku R – NH – R
3, terciální – vznikají náhradou 3 atomů vodíku R – N – R
׀
R
Příprava
Alifatické aminy
- Reakce alkylhalogenidů s roztokem amoniakuCH3Cl + 2 NH3 -> CH3NH2 + NH4Cl
- Reakce alkoholu s roztokem amoniakuCH3OH + NH3 -> CH3NH2 + H2O
Vlastnosti
- Plyny páchnoucí po rybách
- Vyšší aminy jsou kapaliny
- Aminy od naftalenu jsou pevné látky
- Jedovaté, karcinogenní
Základní reakce
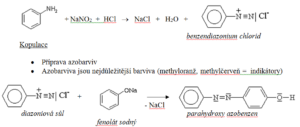
Diazotace
- Reakce primárního aromatického aminu s dusitanem alkalického kovu v přebytku kyseliny za vzniku diazoniové soli
- Diazoniové soli jsou jedovaté látky důležité pro výrobu azobarviv
Zástupci
Anilin
- Jedovatá, olejovitá, vysokovroucí kapalina
- Slouží k výrobě barviv, léčiv a výbušnin
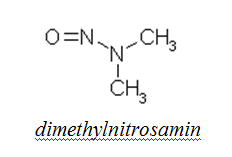
Nitrosaminy
Charakteristika
- Dostávají se do těla z různých zdrojů (potraviny, kosmetika, kouření)
- Karcinogenní látky
- V potravinách se jejich obsah ostře sleduje
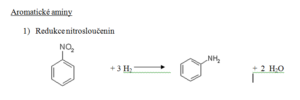
Nitrosloučeniny
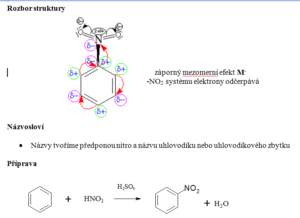
Charakteristika
- Obsahují funkční skupinu NO2
- Vznikají nitrací uhlovodíků
Vlastnosti
- Alifatické nitrosloučeniny jsou slabě páchnoucí kapaliny
- Aromatické nitrosloučeniny voní po hořkých mandlích
- Nerozpustné ve vodě
- Některé jsou jedovaté (proti dravým živočichům)
Základní reakce
Nitrace aromatických uhlovodíků
- Elektrofilní substituce
- Nitrace benzenu za vzniku nitrobenzenu (viz výše)
- Nitrace nitrobenzenu za vzniku m-dinitrobenzenu

Nitrace nasycených uhlovodíků
- radikálová substituce
- NO2∙ – nitroniový radikál
Zástupci
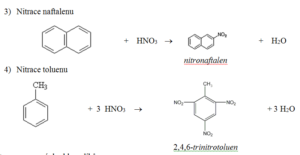
Nitrobenzen
- Jedovatá, nažloutlá, vysokovroucí kapalina mandlové vůně
- Používá se k výrobě anilinu
2,4,6-trinitrotoluen
- Jedovatá výbušnina
- Používá se pro přípravu výbušnin k odstřelování v dolech a lomech
Úkol 1:
Napište vzorce sloučenin
F Br
׀ ׀
CHCl3 F – C – C – H
trichlormethan ׀ ׀
F Cl
2-brom-2-chlor-1,1,1-trifluorethan
CF2 ═ CF2 CH2═CH
tetrafluorethen ׀
Cl
vinylchlorid
H2C ═ CCl – CH ═ CH2 H2C ═ CH – CClH2
2-chlorbuta-1,3-dien 3-chlorprop-1-en