Složení a struktura atomu
- Atom se skládá z kladně nabitého jádra a záporně nabitého elektronového obalu
- Jádro obsahuje protony a neutrony
- Fermiony = proton, neutron, elektron, kvarky
- V jádře je koncentrována veškerá hmotnost celého atomu
- Jádro je v poměru k celému atomu velmi malé
Jádro atomu
- Skládá se z kladných částic protonů p+ a nábojově neutrálních částic neutronů n0 → nukleony (počet udává nukleonové číslo A = N + Z)
- Je v něm koncentrována veškerá hmotnost atomu
- Počet protonů a neutronů v jádře udává nukleonové číslo A
- Počet protonů v jádře udává protonové číslo Z
|
Proton
- P, H (+)
- První důkaz v anodovém záření (Moseley)
Nuklid
- Látka složená z atomů se stejným protonovým a stejným neutronovým číslem
- ® Látka složená z atomů o stejném nukleonovém čísle
Izotopy
- Atomy se stejným počtem protonů, ale s různým počtem neutronů
- ® liší se nukleonovým číslem
Elektronový obal
- Thomson – zjistil e/me = 1,759.1011 C.kg-1
- Je složen ze záporně nabitých elektronů e–, které kompenzují kladný náboj jádra
- Elektrony mají povahu jak částicovou, tak i vlnovou
- Počet elektronů odpovídá počtu protonů v jádře
- e+ – pozitron, náboj stejný s opačným znaménkem
| Částice | Náboj | Hmotnost |
| PROTON | +1,602 × 10-19 C | 1,672 × 10-27 kg |
| ELEKTRON | -1,602 × 10-19 C | 9,109 × 10-31 kg |
| NEUTRON | Bez náboje | 1,674 × 10-27 kg |
Modely atomů
- Thomsův model atomu (Pudinkový model) – J.J. Thomson (1898), atom je tvořen elektricky kladně nabitou látkou, v níž plavou záporně nabité elektrony, celkový náboj je pak nulový

- Planetární model atomu- E. Rutherford (1911); elektrony v atomovém obalu obíhají atomové jádro po neurčených kružnicích (podle modelu by se energie elektronů snižovala, elektrony by se přiblížily k jádru a atom by zanikl) = první rozumný model
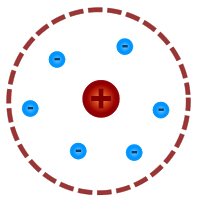
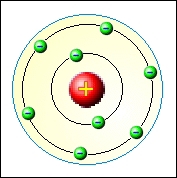
- Bohrův model – Neils Bohr (1913), elektron se může bez vyzařování E pohybovat kolem jádra jen po určitých kvantových drahách, tzv. orbitaly
- Elektron přijímá nebo vyzařuje E pouze při přechodu z jednoho orbitalu na druhý
- Při přechodu na vzdálenější orbital E přijímá, při návratu na bližší orbital E vyzařuje
= 3 postuláty
– model obsahuje jádro a přesně definované sféry energií
E = h.υ → E = h.1/λ (h = Planckova konstanta = 6,626 × 10-34 J.s)
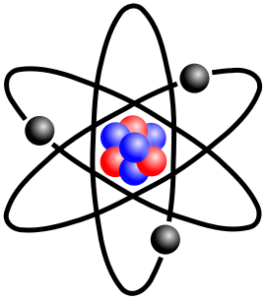
- Kvantově mechanický model atomu – vychází z kvantové mechaniky, elektronům přiřazuje vlastnosti částic i vlnění (vlnová funkce ψ = pozměněná energie)
- Podle Heisenbergova principu neurčitosti nelze přesně určit polohu a hybnost elektronů
- Pouze podle vlnové funkce lze vypočítat pravděpodobnost, s jakou se elektrony vyskytují v daném okamžiku v určité oblasti atomu
Stavba elektronového obalu
Elektronová hustota – hodnota pravděpodobnosti výskytu elektronu
- Oblasti nejhustšího výskytu elektronů v el. obalu = orbitaly
Kvantová čísla
- Charakterizují stav elektronu vyznačující se určitou energií a určitým rozložením elektronové hustoty kolem jádra atomu.
- Hlavní kvantové číslo (n) = 1, 2, 3… (čím vyšší, tím je elektron dále od jádra)
- Vedlejší kvantové číslo (l) = 0, 1, 2,…, n-1 (určuje tvar orbitalu)
- Magnetické kvantové číslo (ml) = -l, -l+1,…, 0,…, +l (určuje orientaci orbitalu v prostoru)
- Spinové kvantové číslo (ms) = +1/2, -1/2 (určuje směr rotace elektronu)
Šestým elektronem ve vrstvě jsou maximálně 2 elektrony.
Elektronová konfigurace
- Ukazuje obsazení atomových orbitalů elektrony
- K jejímu znázornění se používá rámečkových diagramů, elektrony značíme šipkami
- Pro zaplňování elektronového obalu platí určitá pravidla:
- Pauliho princip – V elektronovém obalu se nemohou vyskytovat 2 elektrony, které by měly všechna kvantová čísla stejná, musí se lišit alespoň spinovým číslem
- Hundovo pravidlo – Orbitaly se stejnou energií (degenerované) se obsazují nejprve po jednom elektronu se stejným spinovým číslem, pak až druhým elektronem s opačným spinovým číslem
- Výstavbový princip – Orbitaly s nižší energií se zaplňují dříve než s energií vyšší, pořadí: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p,…
- Uvedená pravidla platí pro elektronovou konfiguraci atomu v základním stavu (s nejnižší energií), dodáním energie se dostane do excitovaného stavu (jeden nebo více valenčních elektronů přejde do vyšší energetické hladiny=excitace)
Periodická soustava prvků
Vychází z periodického zákona (aplikoval ho Moseley – záření, které vychází z jádra je přímosměrné pořadí atomu
- I. Mendělejev (1869)
Periodický zákon
- Vlastnosti prvků jsou periodicky závislé na jejich protonovém čísle
- Grafickým vyjádřením periodického zákona je Periodická Soustava Prvků
Periodická soustava prvků (PSP)
- Prvky jsou zde uspořádány podle vzrůstajícího protonového čísla do:
a) period
b) skupin - Periody – sedm vodorovných řad, udává počet vrstev el.obalu (1-7, K-Q)
- Skupiny – 18 svislých řad, udává počet valenčních elektronů nebo max. ox.č.
- Prvky ve stejných skupinách mají podobné vlastnosti (alkalické kovy, kovy alkalických zemin, halogeny, chalkogeny, vzácné plyny)
- V periodách jsou si nápadně podobné prvky za lanthanem (lanthanoidy) a za aktiniem (aktinoidy) = vnitřně přechodné prvky, vyčleňuj+í se z period
Periodický zákon a valenční elektrony
- Nepřechodné prvky– s-prvky:valenční elektrony zaplňují pouze hladinu ns (prvky 1. A 2. Skupiny+helium); p-prvky: valenční el. Zaplňují ns a np (prvky 13. -18. skupiny)
- Přechodné prvky–d-prvky: valenční el. Zaplňují ns a (n-1)d (prvky 3. -12.skupiny)
- Vnitřně přechodné prvky–f-prvky: valenční el. Obsazují ns a (n-2)f a (n-1)d, tzv. lanthanoidy a aktinoidy
Velikost atomů a PSP
- V periodách se poloměry atomů s rostoucím protonovým číslem zmenšují
- Ve skupinách poloměry atomů nepřechodných prvků 1. až 6. periody s rostoucím protonovým číslem zřetelně rostou
- Poloměry atomů přechodných prvků 5. a 6. periody jsou si blízké.
- Kationty jsou vždy menší než příslušné atomy
- Anionty jsou vždy vetší než příslušné atomy
Periodicity ionizačních energií a elektronových afinit
- Ionizační energie je energie potřebná k odtržení prvního elektronu z obalu atomu.
Hodnoty ionizačních energií s rostoucím protonovým číslem v:
a) skupinách klesají
b) periodách rostou
- Elektronová afinita je energie, která se uvolní, přijme li atom další elektron.
Elektronové afinity prvků 18. skupiny jsou velmi malé (tyto atomy elektrony
nepřijímají).
Největší hodnoty elektronových afinit mají prvky v pravé horní části tabulky (snadno
tvoří anionty).
- Elektronegativita je schopnost přitahovat elektrony sdílené s jinými atomy.
Prvky s malou elekronegativitou tvoří snadno kationty.
Elektronegativita v periodě roste zleva doprava a zdola nahoru.
- Kovový charakter stoupá zprava doleva a svrchu dolů
Prvky podle fyzikálních vlastností:
Nekovy-prvky s velkou el. afinitou, struktura valenčního orbitalu podobná nejbližšímu vyššímu vzácnému plynu (halogeny)
Polokovy– prvky mají některé vlastnosti kovů a některé nekovů (bor, křemík, tellur)
Kovy-prvky s nízkou ionizační energií (snadno tvoří kationty), kovový lesk, velká el. I tepelná vodivost, tažné, kujné (alkalické kovy)
Jaderné reakce
- dochází k samovolné přeměně jádra, nebo účinkem jiné částice
- průběh popsán rovnicemi
Radioaktivita – schopnost atomových jader samovolně se přeměňovat na atomová jádra jiných prvků za současného vyzařování radioaktivního záření- přirozená nebo umělá- poločas rozpadu= doba, za kterou se z výchozího počtu atomů přemění právě polovinaTypy jaderných reakcí
- Prosté přeměny
- Štěpení – u hmotných prvků
- tříštění
Deuterium= atom s jádrem 2H, obsahuje jeden proton a jeden neutron a liší se od běžného vodíku atomovou hmotností (2,0136 mu)
- Syntéza
- pokud je počet nuklidů sudý, izotop bude mnohonásobně stabilnější, než izotop sudý
- jaderná iniciace probíhá buď γ zářením nebo neutronem:
Přirozená radioaktivita=samovolný rozpad v přírodě se vyskytujících radioaktivních nuklidů (asi 50), byly u nich zjištěny 3 typy záření:
- Záření α – proud rychle letících jader atomu (částice α), málo pronikavé, zadrží jej list papíru, silné ionizační účinky
- Záření β– – proud elektronů, které se uvolňují v jádře při přeměně neutronu na proton, pronikavější, menší ionizační účinky
- Záření β+ – proud pozitronů, které se uvolňují v jádře
- Záření γ – elektromagnetické vlnění, nejpronikavější, obvykle doprovází záření β nebo α
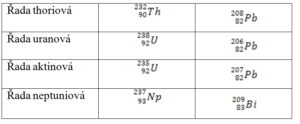
Rozpadové řady
- Radioaktivní přeměna neprobíhá izolovaně, a pokud je následující nuklid radioaktivní, vznikají rozpadové řady
- Každá řada má počáteční radioaktivní a konečný stabilní nuklid
Úkol 1: Pro určité prvky se používají vžité (triviální) názvy. Doplňte chybějící údaje:Alkalické kovy Li, Na, K, Rb, Cs, Fr Kovy alkalických zemin Ca, Sr, Ba, RaChalkogeny O, S, Se, Te, PoLantanoidy prvky s protonovým číslem 58 až 71Transurany prvky stojící v řade za uranemPlatinové kovy Ru, Rh, Pd, Os, Ir, PtÚkol 2:Na příkladu elektronové konfigurace alkalických kovů a halogenů vysvětlete podobné vlastnosti těchto prvků. (el. Konfigurace valenčních elektronů, velikost atomů, ionizační energie, el. Afinita)Alkalické kovy
- Velmi reaktivní
- Mají jeden valenční elektron ® lehce se odtrhuje
- ® vznikají lehce kationty
- Malá ionizační energie
- Malá elektronegativita
- Malá elektronová afinita ® netvoří anionty
Halogeny
- Velmi reaktivní
- Vysoké elektronegativita
- Vysoká el. afinita ® tvoří anionty
- 7 valenčních elektronů
- existují i kationty chlóru
Úkol 3:Jednou z nejtypičtějších vlastností přechodných prvků je schopnost tvořit koordinační sloučeniny. Určete centrální atom, ligandy, koordinační číslo a název následujících sloučenin.K3[Fe(CN)6] – hexakyanoželezitan draselný
1, centrální atom: železo
2, ligandy: kyanid
3, koordinační číslo: 6K4[Fe(CN)6] – hexakyanoželeznatan draselný
1, centrální atom: železo
2, ligandy: kyanid
3, koordinační číslo: 6[Ni(NH3)6] SO4 – síran hexaamin nikelnatý
1, centrální atom: nikl
2, ligandy: amoniak
3, koordinační číslo: 6[Co(NH3)6][Cl]3 – chlorid hexaamin kobaltový
1, centrální atom: kobalt
2, ligandy: amoniak
3, koordinační číslo: 6[Cu(NH3)4][Cl]2 – chlorid tetraamin měďnatý
1, centrální atom: měď
2, ligandy: amoniak
3, koordinační číslo: 4
| Číslo skupiny | Skupinový název | Číslo skupiny | Skupinový název |
|
Alkalické kovy | 15. | Pentely |
|
Kovy alkalických zemin | 16. | Chalkogeny |
| 13. | Triely | 17. | Halogeny |
| 14. | Tetrely | 18. | Vzácné plyny |